电容性:周期表元素关键属性及其对化学绑定的影响
电容性是周期表所有元素的基本特征,测量原子在化学联结内吸引电子向自身的能力关键化学理论概念 1932年美国化学家Linus Pauling
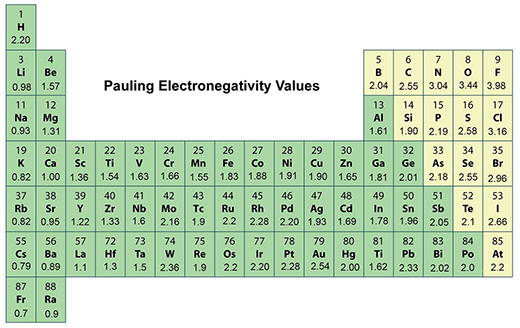
原子在分子中吸引电子自我并扮演重要角色 构造化学领域 固态化学领域 物理领域保令电子化尺度, 最常用并发现于每一化学教科书中, 从0.7到氟4.0不等
高元素电子密度越强,它吸引电子并产生偏负电荷的能力就越强在一个化学联结中,电反原子增电负电,而电反原子减电并增电两种保值原子电子化差决定保值极化,大差表示极共价联结(例如H-F保值)小差表示非极共价联结(例如C-C保值)。
电容性对解析方方面面至关紧要,从化学链路能量到化学化合物易失性不等期望它与材料的多物理属性相关联,包括机械性(如硬性)和电子性能以及光学性能(如色)。
化学家想出各种定义 电子化尺度保灵的尺度是第一和最常用尺度,存在于每一本化学教科书中
电子认知性定义
电容感定义为原子吸引电子密度趋势,即分极化化学联结最常用尺度为热化学保温尺度,电子聚合器有eV单元
1/2.
电容性是一个衍生量,所以无法直接测量相对氢分配值为2.20
电子化实例
氧气中
2分子,两个原子电子密度相同余值联结中的电子在两个氧原子间平均分享
氯原子电子密度比氢原子高,因此联通电子比HCl分子中H接近CI
如何判定电子认知性
保灵用化学联结的能量 从热化学推断出电子化值他建议最简单公式计算保值稳定化,因为原子之间的电子容积差后发现保灵规模预测精度较低
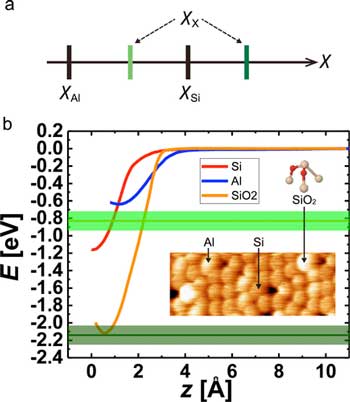
单靠实验判定表原子电容性源码)微电子关系Si Al和未知X原子短程E(z)曲线取自Si(red)、AL(lue)atoms和SiO2欧兰治市SiO联动能预期值2Al小费获取者用光暗绿线表示并带误差带插件显示典型地形AFM图像Si、ALadoms和SiO2si111--7x7表面SiO球棒模型2Si奶油O红(经美国化学学会许可重印)
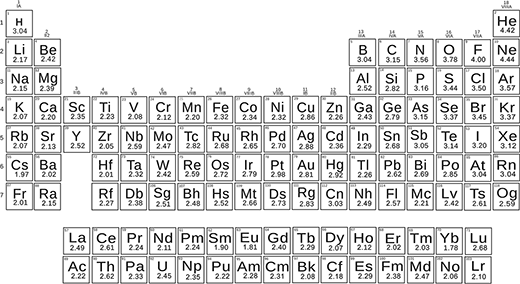
最近科学家修改Pauling公式并重新定义元素电子容造新电子化规模
自然通信:
热化学电子化元素)
Artem R教授解释道,“这一切都从我们决定计算Pauling压力下电子能力时开始。”Organov对应论文编写者高压化学相当奇特但仍然,你可能理解很多事 一旦你发现电子强度 如何改变压力我们用保灵定义 计算正常状态下电子化发现他的尺度与理论或实验联结能量大义核分子不匹配,
并说道:“此外,化学文献中的许多出版物都提到这种前后不一问题,但没有提供一致性解决办法。原因保灵处理 分子离子稳定视之为倍增效果,多项缺陷会消除
以新公式和实验能量化学链路, 科学家判定所有元素的电子强度获取优美规模 并用电子化大小差
新的尺度使用电子化无维量,非常实用并精确复制分子的能量和化学反应
周期表新热化学电子engativ值
多数最小电阴性元素
周期表最大电反作用因子为氟化度(保平尺度3.98和周期表右上角3.98)。最小电反作用元素为(0.79保平尺度并留自周期表底部第二行)。
注意老文本将和都列为0.7最小电阴性值,但值经实验修改为0.79值没有实验数据,但其离子化能比高,因此预计电阻略强
电容周期表趋势
电容常随周期表从左向右移动逐组递减
表示最电阴性元素见周期表右顶部,最小电阴性元素见底层左侧
电容电离能沿同周期表趋势低离子化能元素往往电子强度低核原子不强拉电子类似地,高离子化能元素往往高电子化值原子核强拉电子